Měření tepla
Měření Tepla
Měřením tepla se zabývá kalorimetrie. Základem kalorimetrických úvah je zákon zachování energie, jehož znění vyjadřuje tzv. kalorimetrická rovnice.
Kalorimetrie
Kalorimetrie je část termiky, která se zabývá měřením tepla.
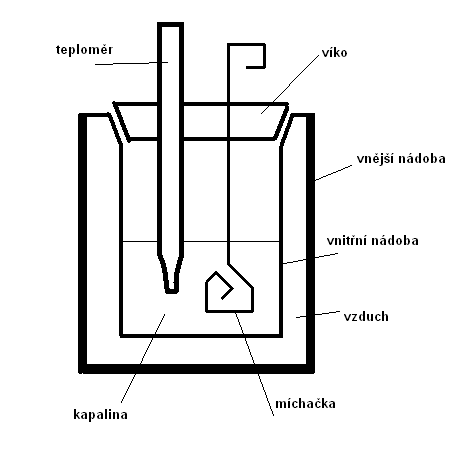
Měřící přístroje: K měření tepla se používá kalorimetr, což je tepelně izolovaná nádoba. Pro různé účely existují různé druhy kalorimetrů.
Např. elektrický kalorimetr se skládá z tepelně izolované nádoby, v níž je teploměr, topná spirála a míchačka (při míchání kapaliny dochází k lepšímu vyrovnání teplot). Průchodem elektrického proudu spirálou dojde k jejímu zahřátí a tímto teplem se zvýší teplota kapaliny v kalorimetru. Vzhledem k tomu, že množství tepla vzniklé ve spirále je závislé na elektrickém proudu a napětí, lze tímto způsobem měřit teplo přijaté kapalinou o dané hmotnosti.
Pro určení tepelné kapacity tělesa pevného skupenství se hodí směšovací kalorimetr, což je tepelně izolovaná nádoba s míchačkou a teploměrem. Do kalorimetru se umístí kapalina o známé tepelné kapacitě K1 a teplotě t1. Do této kapaliny se poté ponoří těleso z pevné látky o teplotě t2, která je vyšší než teplota kapaliny. Mezi kapalinou a tělesem proběhne tepelná výměna a po vytvoření tepelné rovnováhy bude mít soustava teplotu t.
Po vytvoření tepelné rovnováhy odevzdá pevné těleso teplo Q2 = K2(t2 − t) a kapalina přijme teplo Q1 = K1(t − t1). Poněvadž je kalorimetr tepelně izolovaná soustava, bude platit Q1 = Q2, odkud pro tepelnou kapacitu pevného tělesa dostaneme
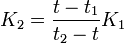
Tento vztah lze považovat za jiný zápis kalorimetrické rovnice.
http://cs.wikipedia.org/wiki/Kalorimetrie Kalometrie - wiki]
--AlbiŠ 31. 5. 2010, 07:18 (UTC)